Роль бобово-ризобиального симбиоза в экологизации почв
Определена зависимость количества клубеньков на корнях бобовых растений от содержания азота в почве. Изучен механизм работы сигнальной системы при формировании бобово-ризобиального симбиоза. Выяснено, какие бобовые культуры являются наилучшими в обогащении почв. Проведен анализ почвы на содержание подвижного аммония, нитратов и гумуса. Проведено лабораторное исследование бактерий рода Rhizobium.
Целью работы является экологизация бедных почв северных районов посредством биологических методов.
Введение
Многие задавались вопросом, когда замечали на корнях бобовых растений небольшие клубеньки. В них находятся азотфиксирующие бактерии, которые состоят в симбиозе с растениями из семейства бобовые. Симбионты – организмы разных видов, находящиеся в тесном сожительстве и тесно связанные как общим домом, так и извлекаемой пользой от такого сожительства. Бактерии обогащают растение азотсодержащими веществами, а растение обогащает бактерии сахарами. Таким образом, из азота они синтезируют большое количество белков и азотсодержащих соединений. Благодаря этому все плоды бобовых растений содержат много белка и незаменимых аминокислот. При изучении азотфиксирующих бактерий мы задались несколькими вопросами. А зависит ли количество клубеньков от содержания азота в почве? Существует ли специальная система, которая регулирует численность клубеньков на корнях бобовых растений? Как происходит инфицирование растения клубеньковыми бактериями? Так как мы живем в северном крае и знаем, что почвы у нас бедные гумусом и азотом, подзолистые и сильно кислые, болотно-мерзлотные и насыпные, хотим предложить биологический метод экологизации почв. Данный метод доступный и незатратный.
Цель: экологизация бедных почв северных районов посредством биологических методов.
Задачи:
- Провести сравнительный анализ почвы, в которой произрастают культурные (Горох посевной (Pisum sativum)) и дикорастущие (Клевер луговой (Trifolium pratense)) бобовые растения.
- Выделить культуры клубеньковых бактерий из клубенька бобового растения.
- Провести сравнительный анализ количества клубеньковых бактерий на корнях культурных и дикорастущих бобовых растений и определить зависимость образования клубеньков от типа почвы и содержания в ней азота.
- Экспериментальным методом выяснить, какие бобовые культуры участвуют в экологизации почв.
- Изучить принцип работы сигнальной системы при формировании бобово-ризобиального симбиоза.
Гипотеза: количество клубеньков на корнях бобовых растений зависит от содержания азота в почве, следовательно, чем менее обогащена почва, тем больше будет образовываться клубеньков.
Объект исследования: растения семейства бобовых Горох посевной (Pisum sativum) и Клевер луговой (Trifolium pratense).
Предмет исследования: клубеньковые бактерии рода Rhizobium.
Методы исследования:
А. Общенаучные:
1. Наглядный
2. Экспериментальный
3. Аналитический
4. Статистический
Б. Частные методы исследования, применяемые в лаборатории:
1. Лабораторный анализ почвы
2. Посев бактерий на питательную среду
3. Окраска по Граму и микроскопирование
4. Лабораторный анализ клубеньков на корнях бобовых растений
1. Исследовательская часть
1.1 Лабораторное исследование почвы
1.1.1 Определение содержания обменного аммония в почве (ГОСТ 26489-85)
Методика. Сущность метода заключается в извлечении обменного аммония из почвы раствором хлористого калия, получении окрашенного индофенольного соединения, образующегося при взаимодействии аммония с гипохлоритом и салицилатом натрия в щелочной среде, и последующем фотометрировании окрашенного раствора.
Y = оптическая плотность · x
За результат анализа принимается единичное определение аммония.
Массовую долю азота аммония в почве определяют непосредственно по градуировочному графику. Если результат определения выходит за пределы графика, определение повторяют, предварительно разбавив фильтрат раствором хлористого калия 1 моль/дм3, результат, найденный по графику, увеличивают во столько раз, во сколько был разбавлен фильтрат.
Результат анализа.
Содержание обменного аммония в пробах составляет:
проба №1 (Комсомольское озеро) = 7,15 млн-1
проба №2 (городской сквер) = 4,89 млн-1
проба №3 (плодородная почва дачного участка) = 8,02 млн-1
1.1.2 Определение содержания нитратов в почве (ГОСТ 26488-85)
Методика. Сущность метода заключается в извлечении нитратов из почвы раствором хлористого калия, последующим восстановлении нитратов до нитритов гидразином в присутствии меди в качестве катализатора и фотометрическом определении их в виде окрашенного диазосоединения.
Y = оптическая плотность · x
Массовую долю азота нитратов в почве определяют непосредственно по градуировочному графику. Если результат определения выходит за пределы графика, определение повторяют, предварительно разбавив фильтрат раствором хлористого калия 1 моль/дм3, результат, найденный по графику, увеличивают во столько раз, во сколько был разбавлен фильтрат.
Результат анализа.
Содержание нитратов в пробах составляет:
проба №1 (Комсомольское озеро) = 0,5517 млн-1
проба №2 (городской сквер) = 0,1397 млн-1
проба №3 (плодородная почва дачного участка) = 24,0 млн-1
1.1.3 Гравиметрическое определение массовой доли органического вещества в торфяных и оторфованных горизонтах почв по методу ЦИНАО
Методика. Метод основан на определении потери массы пробы после прокаливания при температуре 525о С.
Массовую долю зольности торфяных и оторфованных горизонтов почвы (А), в процентах, вычисляют по формуле:
А = 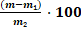 (1)
(1)
m – масса тигля с зольным остатком, г;
m1 – масса пустого тигля, г;
m2 – масса сухой почвы, г;
100 – коэффициент перерасчета в проценты.
Массовую долю органического вещества (Х), в процентах, вычисляют по формуле:
Х = (100 – m) (2)
m – массовая доля зольности, в %.
Результат анализа.
Содержание органического вещества почвы в пробах составляет:
проба №1 (Комсомольское озеро) = 4,87%
проба №2 (городской сквер) = 6,18%
проба №3 (плодородная почва дачного участка) = 57,3%
Таблица 1
Содержание нитратов, подвижного аммония и гумуса в почве
|
№ п |
Место отбора проб |
Содержание массовой доли подвижного аммония в пробу С млн-1 |
Содержание массовой доли азота нитратов в пробе С с млн- |
Содержание массовой доли органического вещества в пробе Х в % |
|
1 |
Комсомольское озеро |
7,15 |
0,5517 |
4,87 |
|
2 |
Городской сквер |
4,89 |
0,1397 |
6,18 |
|
3 |
Плодородная почва дачного участка |
8,02 |
24,0 |
57,3 |
1.2 Культивирование бактерий Rhizobium
Выделение чистой культуры: посев бактерий на питательную среду (гороховый агар).
Из клубеньков однолетних бобовых растений бактерии выделяют в период бутонизации – цветения растения-хозяина, у многолетних – на второй год жизни. От тщательно промытого в водопроводной воде корня отделяют пинцетом или бритвой наиболее крупные розовые клубеньки, помещают их в фарфоровый тигель Гуча с сетчатым дном и погружают тигель в несколько большие, чем он, по размеру фарфоровые чашки с 96 %-м этиловым спиртом. После этого тигель с клубеньками многократно промывают стерильной водой. Стерильным пинцетом переносят клубеньки в стерильную чашку Петри и стерильным ножом разрезают их на части. Бактериологической петлей берут небольшое количество содержимого клубенька, переносят в каплю стерильной воды на поверхность агаровой питательной среды в чашке Петри и выполняют посев.
Чашки Петри термостатируются при температуре 28 градусов. Быстрорастущие клубеньковые бактерии появляются на третий-четвертый день, медленнорастущие – на седьмой-девятый [1, с. 108-110].
1.3 Окраска бактерий по Граму
Реактивы: раствор генцианового фиолетового, раствор Люголя, раствор фуксина, этиловый спирт 96% [2, с. 340-341].
Результат: при окрашивании мы обнаружили, что все 3 пробы бактерий грамотрицательные. Так как стенка у них тоньше, чем у грамположительных бактерий, и она содержит меньше муреина, но защищена внешней мембраной от проникновения различных веществ. Благодаря этому она обесцвечивается и при добавлении фуксина окрашивается в красный цвет.
1.4. Морфология бактерий Rhizobium
При микроскопировании бактерий мы установили морфологию.
Морфология бактерий Rhizobium: подвижны, палочки 1,2-3 мкм длиной, 0,5-0,9 мкм шириной, грамотрицательные, спор не образуют. При старении бактерии теряют подвижность [3, с. 37], [4, с. 98-99].
1.5 Лабораторный анализ клубеньков на корнях бобовых растений
Таблица 2
Среднее и округленное значение количества клубеньков бактерий рода
Rhizobium на одном бобовом растении
|
|
Почва комсомольского озера |
Почва городского сквера |
Плодородная почва дачного участка |
|
Горох посевной (Pisum sativum) |
6,6 ≈ 7 |
11,1 ≈ 11 |
2,7 ≈ 3 |
|
Клевер луговой (Trifolium pratense) |
7,2 ≈ 7 |
15,5 ≈ 16 |
3,6 ≈ 4 |
Вывод. Таким образом, из таблицы 2 видно, что клубеньков у Клевера лугового (Trifolium pratense) в бедной почве больше, чем в богатой азотом почве. А у Гороха посевного (Pisum sativum) клубеньков образуется меньше, так как это культурное растение и оно более прихотливо к условиям среды, следовательно, чем меньше содержание азота в почве, тем больше клубеньков образуется на их корнях. Это происходит благодаря сигнальной системе бобовых растений, которая регулирует численность бактерий.
В результате анализа статьи автора А.К. Глянько [5, с. 453-454] был выявлен принцип работы сигнальной системы бобово-ризобиального симбиоза. Специальные NOD-факторы бактерий взаимодействуют с рецепторами клеток бобовых растений, и бактерии распознают у них растительные флавоноиды. Из-за этого у ризобий начинается транскрипция генов, которые нужны для инфицирования и создания клубенька. После этого этапа в клетке резко повышается содержание ионов кальция Ca2+, они начинают забрасываться в клетку из внеклеточного пространства. Резкое повышение ионов кальция активирует кальмодулинзависимую киназу (CCaMK) и варьирует гормональный баланс. Это способствует начальному образованию клубенька. Следовательно, сигнальные системы существуют у бактерий рода Rhizobium и у бобовых растений. При избытке азота в почве клубеньков на корнях образуется мало. Это объясняется тем, что растение не готово отдавать бактериям свои сахара и устанавливать симбиоз, так как содержание азота в почве достаточное. Но при недостатке азота в почве будут устанавливаться мутуалистические взаимоотношения между бактериями Rhizobium и бобовыми растениями. Тем самым растения отдают бактериям сахара, а бактерии фиксируют им азот.
Выводы.
1. Таким образом, лабораторный анализ почв показал, что 3 пробы отличаются по содержанию подвижного аммония, нитратов и гумуса.
2. Мы лабораторным методом получили колонии бактерий рода Rhizobium для изучения их морфологии.
3. Таким образом, у бобовых растений существует сигнальная система, благодаря которой формируются клубеньки на их корнях. Чем менее обогащена почва азотом, тем больше клубеньков образуется на корнях бобовых, так как при его нехватке растения активнее вступают в симбиоз, для того чтобы получать больше азотсодержащих веществ. Когда азота в почве достаточно, то растения менее активно вступают в симбиоз, чтобы не отдавать свои сахара бактериям. Клубеньковые бактерии при благоприятных условиях в течение года на 1 га могут зафиксировать 200 кг атмосферного азота, это значительно повысит плодородность почвы.
4. Для обогащения почвы азотом лучше засевать поля, газоны и клумбы города Нижневартовска Клевером луговым, так как он неприхотлив к условиям среды (хорошо растет и будет образовывать клубеньки), быстро перегнивает, образуя большое количество гумуса. Также Клевер луговой является кормовой культурой, защищает почву от ливней и ветра [6, с. 56]. Бобовые культуры имеют важное значение как элементы экологизации и биологизации почв. Так как в городе Нижневартовске почва насыпная, подзолистая, болотно-мерзлотная, то посевы Клевера лугового (Trifolium pratense) улучшают физико-химические показатели почвы, а также замедляют её деградацию.
5. На сегодняшний день стоит большая проблема загрязнения почв азотосодержащими удобрениями, поэтому мы и предлагаем экологизировать и биологизировать почвы, через посевы Клевера лугового (Trifolium pratense)
Благодарность. Для проведения лабораторных исследований: анализа почв, культивирования бактерий рода Rhizobium, мы воспользовались лабораторией Нижневартовского государственного университета. Выражаем особую признательность сотрудникам университета за содействие.
- Т.В. Зимоглядова, И.А. Карташёва, О.Г. Шабалдас «Практикум по микробиологии», издательство «АГРУС», 2007 г.
- А.С. Лабинская «Микробиология с техникой микробиологических исследований», издателььство «Медицина», изд. 4-ое, 1978 г.
- Р.Г. Госманов, А.К. Галиуллин, Ф.М. Нургалиев «Основы микробиологии», издательство «Лань», изд. третье, стереотипное, 2022 г.
- Хоулт Дж., Криг Н. «Определитель бактерий Берджи», том 1, издательство «Мир», девятое издание, перевод с английского под редакцией РАН Г.А. Заварзина, 1997 год.
- А.К. Глянько, Сибирский институт физиологии и биохимии растений СО РАН, Иркутск, «Сигнальные системы ризобий (Rhizobiaceae) и бобовых растений (Fabaceae) при формировании бобово-ризобиального симбиоза» 2015 г. Журнал «Прикладная биохимия и микробиология, 2015, том 51, №5, с. 453-464».
- Борисова Елена Егоровна, канд. с.-х. наук, доцент кафедры НГИЭУ, г. Княгинино, РФ, «Роль клевера лугового в экологизации и биологизации замледелия», 2016 г. Журнал «Международный научный журнал «Символ науки» №4/2016».