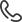Алгоритм экспресс-диагностики хронических аутоиммунных гепатитов по слюне методом монохромного анализа наночастиц
Хронический аутоиммунный гепатит является актуальной проблемой современной медицины ввиду широкой распространённости среди всех аутоиммунных заболеваний (более 25%) и трудностью его диагностики, связанной с отсутствием надёжных серологических тестов для его выявления. Целью настоящей работы явилось изучение возможности метода монохромного анализа наночастиц в неинвазивном выявлении АИГ и разработка алгоритма экспресс-диагностики хронических аутоиммунных гепатитов по слюне. Поставленная цель решалась выполнением ряда задач: разработка диагностического алгоритма монохромного анализа наночастиц для определения выраженности и патофизиологической направленности гомеостатических сдвигов у больных с верифицированным диагнозом хронического аутоиммунного гепатита по образцам ротоглоточных смывов (слюны), а также расчёт показателей диагностической специфичности и чувствительности теста. Материалы и методы: исследования проводились в «Центре европейской и восточной медицины» с 2019 по 2022 год, и были обследованы 14 пациентов с верифицированным диагнозом аутоиммунного гепатита. Установлено, что наиболее типичные спектры слюны больных с аутоиммунным поражением печени характеризовались трёхмодальностью и преимущественностью рассеяния света на частицах сверхкрупного диаметра (свыше 1000 нм) и значительным увеличением вклада в светорассеяние наночастиц мелкого и среднего гидродинамического размера, что являлось статистически достоверным (р<0,001) при проведении сравнительного анализа со спектрами слюны практически здоровых лиц и пациентов с общесоматическими заболеваниями печени не аутоиммунного генеза. Показатели диагностической чувствительности в отношении аутоиммунного гепатита составили 95%, диагностической специфичности – 93%. Выводы: результатами проведенного научного исследования явились разработанный алгоритм применения лазерной спектроскопии слюны для неинвазивной экспресс-диагностики хронических аутоиммунных гепатитов, когда со своевременно выставленным диагнозом лечебные мероприятия будут являться максимально эффективными и направленными на профилактику осложнений и системных проявлений заболевания, и расчёт показателей диагностической чувствительности и специфичности метода монохромного анализа наночастиц.
Аутоиммунный гепатит (АИГ) является хроническим заболеванием печени неуточнённой этиологии, характеризующееся аутоиммунным воспалением, гипергаммаглобулинемией и сопряжённостью с лейкоцитарными антигенами человека (HLA) DR3 и DR4 [1]. Распространенность АИГ в Европе и США составляет до 20 случаев на 100 тысяч населения [2]. В РФ количество больных АИГ составляет около 40 тысяч, что сопоставимо с выявляемостью других заболеваний, относящихся к аутоиммунным, более чем в 80% случаев АИГ диагностируется преимущественно у женщин молодого возраста [3]. По зарубежным данным доля больных АИГ достигает 25% от всех больных хроническим гепатитом (ХГ) [4]. Актуальность проблемы АИГ обусловлена сложностью его диагностики [5]. Вирусы хронических гепатитов, герпеса могут индуцировать развитие АИГ у лиц с генетической предрасположенностью [6]. По имеющимся литературным данным, у многих больных АИГ в крови обнаруживаются антивирусные антитела, что указывает на их определённую роль в развитии процесса аутоиммунизации [7]. Более того, описаны клинические случаи латентного течения АИГ с манифестацией после инфицирования вирусом хронического гепатита [8].
Современные представления о патогенезе АИГ отмечают сочетание воздействия на организм больного неблагоприятных факторов окружающей среды, нарушения иммунорегуляторных механизмов и наследственной предрасположенности, что приводит к активации Т-клеток против гепатоцитов, обусловливая, в итоге, появление некровоспалительных и фибротических изменений в печени [9]. Аутоиммунными заболеваниями (АИЗ) считаются те, в основе которых формируется иммунное поражение собственных тканей организма [10]. Присутствующие в крови в незначительном количестве естественные аутоантитела в норме не вызывают аутоиммунного повреждения, а, наоборот, стимулируют регенеративные процессы [11]. Поэтому, для развития АИЗ, в т.ч. АИГ, необходимо не только увеличение их количества аутоантител, но и присутствие качественных изменений, таких как: усиление антигенной специфичности, повышение авидности и др. [12].
В современной медицине используется «серологическая» классификация АИГ, согласно которой выделяется 4 вида АИЗ печени [13]. АИГ первого типа характеризуется наличием у больных антинуклеарных антител и антител к гладкой мускулатуре. Второй тип АИГ проявляется образованием антител к микросомам печени и почек. Третий тип АИГ выделяют на основании обнаружения в крови антител к растворимым печеночным антигенам. Эти антитела образуются только при аутоиммунном гепатите и служат его важным серологическим маркером. Четвёртый тип АИГ часто выявляется в детском возрасте и характеризуется продукцией антител против F-актина [14].
В настоящее время не существует надёжных скрининговых маркеров для выявления и дифференциальной диагностики АИГ, которые крайне необходимы в случае уточнения диагноза в случаях гепатитов неизвестной этиологии, а также известной этиологии в случае атипичного течения [15]. Серологическая лабораторная диагностика АИГ проводится по антителам, а именно: антинуклеарным антителам (АNА), антигладкомышечным антителам (SMA), антителам к к микросомам печени и почек 1 типа (анти-LKM-1) и антителам к печеночно-цитозолному антигену (анти-LC1), антителам к печеночно-панкреатическим антигенам (LP), антителам к асиало-гликопротеиновым рецепторам и антителам к антигенам плазматической мембраны гепатоцитов (LM) [16]. Но диагностическая эффективность данных исследований не высока, потому что данные аутоантитела не являются специфичными для АИГ и их наличие или отсутствие в крови пациента во многом зависит от многочисленных факторов внешней и внутренней среды организма и особенностей течения болезни [17]. Отсутствие антител не свидетельствует об отсутствии АИГ, т.к. они могут вырабатываться позднее по мере прогрессирования заболевания, либо не определяться совсем, но, как правило, их уровень коррелирует со степенью активности аутоиммунного процесса [18].
Критерии диагностики АИГ были разработаны в конце прошлого века Международной группой по изучению аутоиммунного гепатита: более чем полуторакратное превышение уровня гамма-глобулинов и иммуноглобулинов класса джи; превышение титров ANA, SMA и LKM-1 1:88 для взрослых и 1: 20 для детей [19]. Диагностические критерии АИГ неспецифичны и в настоящее время не существует ни одного, который позволял бы верифицировать диагноз [20].
Впервые концепция аутоиммунных повреждений печени была подтверждена выявлением в сыворотке крови больных антиядерных антител, которые в 60% случаях обнаруживались в крови больных АИГ, что позволяет дифференцировать его, например, от гепатитов вирусной этиологии [21]. Тем не менее антиядерные антитела могут встречаться и у практически здоровых людей, возрастая с возрастом, приёмом лекарственных препаратов, отравлениях, интоксикациях и при беременности [22]. Последующим этапом диагностического поиска можно считать определение антител к митохондриям, микросомальному антигену печени и к нейтрофилам методом непрямой иммунофлуоресценции (НИФ), существенным недостатком которого является субъективность способа оценки результата анализа [23].
При диагностике АИГ незаменимым методом верификации диагноза остаётся биопсия печени, которая является «золотым стандартом»: при гистологическом исследовании определяются ступенчатые и мостовидные некрозы паренхимы, розеткообразование гепатоцитов, увеличение плазматических клеток в воспалительном инфильтрате в портальных трактах и участках некроза гепатоцитов и лимфоидная инфильтрация долек печени [24].
Достаточно часто АИГ сочетаются с другими аутоиммунными состоянияим, такими как аутоиммунный тиреоидит, витилиго, алопеция, неспецифический язвенный колит, ревматоидный артрит, аутоиммунный гломерулонефрит и сахарный диабет [25]. Научными исследованиями показано, что данные аутоиммунные заболевания могут быть не только следствием потери толерантности, но и результатом повышения экспрессии генов RAG1 и RAG2, которые ответственны за активацию рекомбинации генов [26]. Экспрессия генов RAG1 и RAG2 повышена на аутоагрессивных клетках [27].
Учитывая рост выявления аутоиммунной патологии у лиц с наличием факторов риска в анамнезе, имеется необходимость актуализировать проблемы диагностики АИГ в повседневной врачебной практике.
Общим недостатком «традиционных» методов лабораторной диагностики АИГ является инвазивность данных процедур, высокая себестоимость и невозможность применения в качестве скринирующего метода обследования больших когорт населения.
В идеале лабораторный метод диагностики АИГ должен позволять детектировать не один тип биохимических маркеров, как это происходит при применении большинства лабораторных тестов, а весь их интегральный спектр. Таким методом может явиться монохромный анализатор наночастиц (МАН), который является усовершенствованной модификацией метода лазерно-корреляционной спектроскопии (ЛКС) [28], что обусловливает их широкое применение в приборах различных фирм для медицинских и биологических исследований [29]. По сравнению с другими методами медико-биологических исследований, метод МАН обладает рядом существенных преимуществ: широким диапазоном исследуемых фракций, возможностью одновременного анализа частиц разных гидродинамиических диаметров (структурно-функциональный анализ молекулярных ингредиентов биологических жидкостей), учётом характера межмолекулярных взаимодействий отдельных ингредиентов, достаточностью минимального количества исследуемого биоматериала, простой процедурой подготовки образцов к анализу, высокой скоростью измерений изучаемого образца и получения качественной и количественной информации [30].
Лазерная спектроскопия, в целом, и МАН, в частности, основаны на методологии динамического светорассеяния (ДС). Для измерения таких спектров применяются методы оптического смешения на основе гетеродинирования и исследования самобиений частот рассеянного света [31].
Метод гетеродинирования заключается в смешении опорного лазерного излучения и излучения, рассеянного на исследуемом образце, на чувствительном элементе фотоприемника [32]. В этом случае фототок пропорционален квадрату суммы поля опорного излучения и поля рассеянного излучения [33]. Сущность метода самобиений состоит в том, что свет, рассеянный исследуемым участком образца, направляется на фотоприемник, на котором и возникают биения между различными частотными компонентами спектра падающего света [34]. При этом ток фотоприемника оказывается промодулированым по амплитуде частотами биений флуктуаций концентраций частиц под воздействием света, рассеянного на исследуемом образце от нуля до ширины спектра рассеяния [35]. Релаксация микроскопических флуктуаций концентрации частиц к равновесному состоянию описывается уравнением диффузии:
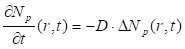 (1.1)
(1.1)
где 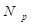 – концентрация частиц,
– концентрация частиц, 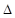 – оператор Лапласа и D – коэффициент диффузии, который является ключевым параметром для определения размеров исследуемых частиц.
– оператор Лапласа и D – коэффициент диффузии, который является ключевым параметром для определения размеров исследуемых частиц.
Решением уравнения диффузии в одномерном случае является экспоненциальная функция с показателем степени, содержащим коэффициент диффузии частиц D. В случае рассеяния света на флуктуациях концентрации монодисперсных частиц, решением является корреляционная функция поля 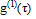 :
:
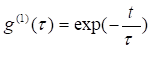 (1.2)
(1.2)
где τ – время релаксации флуктуаций концентрации частиц, которое обратно пропорционально характерной ширине Г спектра мощности света.
Спектр мощности рассеянного света в случае, когда частицы в растворе одного размера, представляет собой Лоренциан, максимум которого, расположен на частоте возбуждающего света. Ширина Лоренциана на полувысоте равна:
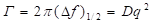 (1.3)
(1.3)
где D – коэффициент диффузии частиц, q – волновой вектор рассеяния света.
Метод ДС позволяет определять размеры частиц в моно- и полидисперсных растворах. При исследовании полидисперсных растворов, каковыми являются практически все биологические жидкости, крайне важно, кроме определения размеров белков, агрегатов и везикулярных частиц не нарушать их целостность и концентрацию и, для этого, необходимо проводить измерения в их естественной среде.
Обработка рассеянного света базируется на следующем алгоритме.
Спектр мощности рассеянного света, падающего на фотоприемник, представляет собой Лоренциан, и в случае непрерывных распределений частиц по размерам имеет следующий вид:
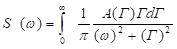 (1.4)
(1.4)
где А(Г) – функция распределения интенсивности рассеяния частиц по характерным для них диффузионным уширениям.
Наибольший интерес представляет вариационный метод, так как именно он используется в работе для обработки результатов [36].
Биологические жидкости находятся в тонком равновесии, определяемом ионной силой раствора, значением рН и рядом других факторов [37]. Это обстоятельство исключает возможность изучения распределения размеров белков, антител, циркулирующих иммунных комплексов, липопротеинов и агломератов объектов в биологических жидкостях всеми классическими методами (в том числе методами проточной цитометрии), так как эти методы требуют препарирования образцов, приводящего к изменению условий существования, входящих в них агломератов [38]. Этого недостатка лишен метод МАН, который может применяться к исходному образцу нативной биологической жидкости. Метод МАН способен также обнаруживать незначительные изменения исследуемого объекта при сравнении спектров света, рассеянного образцом до и после изменения условий. Информация об исследуемом объекте методом МАН максимально достоверна т.к. в процессе измерений состояние образца не меняется под действием внешних факторов (лазерного излучения, температуры, химических реагентов и т.д.).
При патологических процессах, происходящих в организме человека, в крови увеличивается количество циркулирующих нанокомплексов, в первую очередь, внеклеточных везикул, а их вид и состав различны в зависимости от вида патологии [39]. Впоследствии эти везикулы поступают во все органы и ткани организма. За работы по изучению везикулярного обмена информацией в организме в 2013 году была присуждена Нобелевская премия: «Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт» [40].
Для проведения исследований необходимо получить раствор слюны. Это требование связано с тем, что исследование неразбавленных образцов слюны не отвечает важному теоретическому аспекту метода МАН, а именно принципу «однократного рассеяния света» [41]. Выбор концентрации раствора слюны был основан на влиянии на результат измерений нескольких факторов, а именно: высокая концентрация частиц малых размеров сказывается на детектируемых размерах, связанных с взаимодействием между молекулами белка; малая концентрация крупных частиц в объеме рассеяния влияет на низкочастотную область спектра мощности и, следовательно, дополнительного пика в распределении мощности по размерам; при большой концентрации крупных частиц измерениям может мешать двукратное и многократное рассеяние; при низкой концентрации частиц в растворе уровень полезного сигнала незначительно превышает уровень шумов [42].
Для устранения возможных погрешностей при измерениях был проведен ряд тестирований НБЖ с целью определения оптимальной концентрации раствора слюны для исследований. Были получены следующие результаты: при концентрациях раствора от 1 % до 10 % в Фурье-спектрах мощности рассеянного света наблюдаются шумы, по порядку величины сопоставимые с уровнем полезного сигнала; с увеличением концентрации раствора с 1% до 20% мощность рассеянного света линейно возрастает; при концентрации свыше 20% мощность рассеянного света выходит на постоянный уровень. Такая зависимость может быть связана с процессом многократного рассеяния света исследуемым объектом. Исходя из полученных данных выбран оптимальный диапазон концентраций от 10% до 20%.
Специфика исследования биологических жидкостей человека.
В медицинской диагностике для установления заболевания и контроля за его течением исследуют различные биологические жидкости организма: кровь, слюну, ликвор, мочу. Все эти жидкости имеют сложный белковый состав. Наибольший интерес имеет исследование слюны в виде ротоглоточных смывов по причине неинвазивности забора биоматериала у пациента.
Пациенту предлагают 30 мл физиологического раствора, в разовом стакане и просят тщательно (в течение 0,5-1 мин.) прополоскать полость рта и глотки и сплюнуть жидкость обратно в стакан. Из полученной взвеси микропипеткой объемом 1000 мкл отбирают 1 мл в стерильную одноразовую пробирку, закупоривают и центрифугируют в при 2500 об/мин в течение 5 мин. 0,8 мл надосадочной жидкости осторожно (чтобы не задеть осадок) переносят в кювету спектроскопа для исследования. Суть предлагаемого метода заключается в анализе рассеянного света, получаемого путем просвечивания лазером биологической жидкости человека. Лазерный луч фокусируется на образце. Белки, находящиеся в жидкости, рассеивают свет, который фиксируется детектором. По характеру изменения интенсивности рассеянного света во времени можно определить, какого размера наночастицы находятся в жидкости. Размеры детектируемых молекул зависит от наличия в организме исследуемого тех или иных заболеваний. Учитывая успешность применения метода ЛКС [43], в последние годы появилась возможность усовершенствования приборной базы и программного обеспечения, что легло в основу монохромного анализатора наночастиц (МАН).
Цель настоящей работы – изучить возможности метода монохромного анализа наночастиц в неинвазивном выявлении АИГ и разработать алгоритм экспресс-диагностики хронических аутоиммунных гепатитов по слюне методом МАН. Поставленная цель решается выполнением ряда задач: разработка диагностического алгоритма монохромного анализа наночастиц для определения выраженности и патофизиологической направленности гомеостатических сдвигов у больных с верифицированным диагнозом АИГ по образцам ротоглоточных смывов (слюны), а также расчёт показателей диагностической специфичности и чувствительности теста.
Материалы и методы
Состав установки МАН: спектрометр лазерный с длиной волны 633 нм; персональный компьютер с эксклюзивным программным обеспечением для приёма сигнала с аналого-цифрового преобразователя и последующей обработки результатов исследования; лабораторная посуда для подготовки образцов к исследованию [44].
Спектрометр МАН состоит из следующих узлов: оптический блок; кювета для исследования биологической жидкости; гелий-неоновый лазер (длина волны - 633 нм); фотоприёмник; аналого-цифровой преобразователь (АЦП); блок питания.
Оптический блок спектрометра состоит из оптических элементов, фокусирующих лазерный на кювете с исследуемым образцом биологической жидкости и собирающих рассеянный свет от кюветы с находящейся в ней исследуемой НБЖ на фотоприемное устройство [45]. Оптический блок спектрометра выполняет фиксацию положения лазера, фотоприемного устройства и элементов формирующей оптики. Лазерный модуль состоит из гелий-неонового лазера и блока его питания. Фотоприемное устройство (ФПУ) предназначено для регистрации рассеянного света от частиц исследуемого образца, преобразования его в электрический сигнал и усиления его для подачи на АЦП. Фотоприёмник обеспечивает высокую чувствительность преобразования падающего света лазера в электрический ток. АЦП представляет собой 14-разрядный преобразователь входного напряжения в диапазоне от 0 до 3 вольт в полосе частот от 0 до 10 МГц. Подача оцифрованного сигнала на компьютер осуществляется через USB-порт. Блок питания спектрометра предназначен для получения стабильного напряжения, необходимого для питания электронных устройств прибора из напряжения 220 В с частотой 50 Гц.
Принципиальная оптическая схема спектрометра МАН приведена на Рис. 1.
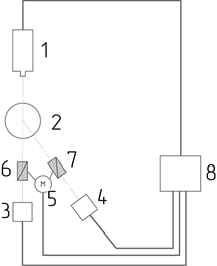
Рис. 1. Блок-схема монохроматического анализатора наночастиц, где 1 – лазер; 2 – кювета; 3, 4 – фотоприемные устройства; 5 – поворотный блок; 6, 7 – поляризаторы; 8 – электронный блок.
Исходя из того, что объектом исследований являются жидкости, в т.ч. биологические, которые содержат в своём составе наночастицы белков, длина волны излучения устанавливалась исходя из спектров поглощения белков, воды, и крайних размеров белковых комплексов слюны порядка от 1 нм до 1000 нм. Выбор длины волны лазерного излучения в окне прозрачности спектра поглощения воды позволяет избежать потери мощности излучения за счет поглощения и, соответственно, возбуждения молекул воды. В связи с вышесказанным для исследования водных растворов слюны оптимальным является длина волны лазерного излучения 633 нм.
Метод МАН, используемый в настоящих исследованиях, суть которого заключается в модуляции лазерного излучения частотой броуновского колебания исследуемых частиц, подразумевает, что влияние фотонов света лазерного излучения не должно вносить значимых изменений в исследуемую систему. Таким образом, к рабочим узлам аппаратуры, одним из которых является лазерный модуль, предъявляются высокие требования.
Прибор МАН предназначен для исследования органических и неорганических наночастиц в жидкостях, в том числе биологических. По своим параметрам МАН не уступает зарубежным ЛК-спектрометрам (быстродействие составляет 1-5-10 минут в зависимости от количества накоплений), что может влиять на погрешность измерений, объем исследуемой жидкости от 0.5 мл до 5 мл, диапазон измеряемых размеров частиц от 1 нм до 10 мкм. Таким образом, результаты измерений показывают, что МАН позволяет получать достоверные результаты, а также исследовать полидисперсные растворы биологических жидкостей, такие как слюна и плазма крови. Применяемый способ позволяет оценить состояние организма путем прямого измерения распределения по размерам наноструктур в слюне человека по результатам МАН-исследования.
При исследовании параметров частиц методом МАН важно минимизировать влияние факторов на исследуемую среду, в том числе и нелинейные эффекты. Это связано с тем, что информация о размерах и процентном соотношении частиц в образце слюны связана с мощностью рассеянного ими света. Растворы наночастиц в слюне обычно малоконцентрированы и могут проявлять нелинейные свойства при взаимодействии с низкоинтенсивным лазерным излучением. В зависимости от свойств слюны и содержащихся в ней наночастиц, различных по форме и размерам нелинейность интенсивности выходного излучения в зависимости от входной интенсивности носит различный характер. Для автоматизации обработки выходных данных спектрометра МАН был использован аналого-цифровой преобразователь АЦП Е20-10, поставляемый фирмой LCard в комплекте с АЦП. Это позволило записывать сигнал с МАН в цифровом формате на жёсткий диск персонального компьютера. Для визуализации результатов исследования образцов применялась программа-классификатор, которая позволяла в автоматическом режиме анализировать спектры, выдавая информацию о гидродинамических размерах наночастиц и их вкладе в светорассеяние. Алгоритм работы программы-классификатора основан на т.н. методе «теория групп», когда индивидуальные спектры дифференцируются между собой в 32-мерном пространстве. Для каждой из двух сравниваемых групп проводились границы зон, которые соответствовали дисперсиям распределений "две сигмы". Масштабы по осям отображались в логарифмическом масштабе. Результаты измерения образцов слюны методом МАН представляются в виде гистограмм, описывающих вид функции распределения частиц слюны по размерам (диаметру) и вкладу в светорассеяние, при этом высота пиков пропорциональна относительному вкладу частиц данного диаметра в суммарный спектр лазерного излучения в заданном частотном диапазоне. Весь диапазон спектра от 1 до 10000 нм условно разделялся на пять фракций (поддиапазонов) соответственно размерам детектируемых наночастиц: 1 – 10 нм; 11 – 30 нм; 31 – 70 нм; 71 – 150 нм; > 151нм. Статанализ данных проводился с вычислением показателя «среднее арифметическое» и его стандартной ошибки, а в случае попарного сравнения результатов исследования, полученных от двух и более групп, – метод «попарного множественного сравнения» [46].
Для оценки достоверности показаний МАН проводились измерения опытных образцов, которые состояли из сферических наночастиц латекса диаметром 100 нм и в виде суспензии находились в водном растворе. Их размеры, полученные после обработки данных в программе-классификаторе составляли 96-102 нм. По серии проведенных измерений относительная погрешность составила не более 4%. Результаты замеров частиц латекса с диаметром 100 нм в водной суспензии показаны в Таб. 1.
Таблица 1.
Результаты замеров сферических наночастиц латекса диаметром 100 нм
|
№ измерения |
Первая серия измерений |
Вторая серия измерений |
|
Средние размеры наночастиц латекса, нм |
||
|
1 |
102 |
101 |
|
2 |
98 |
100 |
|
3 |
96 |
98 |
Важным фактором в измерениях, проводимых методом МАН, является время экспозиции. Измерения проводились несколько раз подряд (время одного измерения составляет 10 минут), пробирка с раствором не извлекалась из кюветы и воздействие на образец лазерного излучения было постоянным.
Забор слюны у пациентов проводился строго натощак, перед взятием биоматериала проводилось предварительное полоскание полости рта в течение 10-15 секунд 25-40 мл изотонического раствора натрия хлорида. Хранение образцов осуществлялось при комнатной температуре – в течение 6 ч., при температуре от 2°С до 8°С – в течение 3 суток, при температуре минус 20°С – в течение полугода, при температуре минус 70°С – длительно.
Определение размеров наночастиц слюны проводилось следующим образом: раствор слюны в виде ротоглоточного смыва (РГС) после 10-минутного центрифугирования при 2500 об/мин микропипеткой отбирался и помещался в кювету МАН, проводилось три измерения подряд в течение 10 минут каждое, раствор постоянно находился под воздействием лазерного излучения, при комнатной температуре.
Исследования слюны в виде РГС методом МАН проводилось в «Центре европейской и восточной медицины» с 2019 по 2022 год, и были обследованы 14 пациентов с верифицированным диагнозом АИГ. Большинство обследованных (более 80%) пациентов были в возрасте от 21 до 69 лет. Более 80% из них составили женщины. Заключение о состоянии здоровья давалось на основании результатов комплексного медицинского обследования больных в медицинских учреждениях по месту жительства. Обследование пациентов с АИГ проводили в соответствии со стандартом ведения стационарного больного, начиная с жалоб и сбора анамнеза. Всем больным выполняли традиционные лабораторные исследования (общий и биохимический анализ крови), общий белок и фракции, СРБ, клеточная и гуморальная иммунограмма. Морфофункциональное состояние печени оценивалось по результатам ультразвукового исследования и биопсии. По превалирующей симптоматике основного патологического процесса исследуемые были разделены на три группы: основную (больные с верифицированными случаями АИГ) – 14 наблюдений, группу сравнения (больные с хроническими заболеваниями печени не аутоиммунной этиологии) – 18 случаев, и контрольную группу (практически здоровые пациенты) – 23 наблюдения. Всем пациентам проводилась лазерная спектроскопия слюны.
Осмотр пациентов "узкими" специалистами (гастроэнтеролог, иммунолог, инфекционист, ревматолог и др.) проводился по показаниям.
Формирование обследуемых групп проводилось по правилам проведения клинических испытаний, у всех пациентов было взято «информированное согласие» на участие в исследованиях. Научно-исследовательская работа проводилась в соответствии с Хельсинкской декларацией (2013 г.), и была предварительно одобрена «Комитетом по этике».
Статистическая обработка полученных результатов исследования проводилась с использованием программного обеспечения Statistica 10.0, а также корреляционно-регрессионным анализом. Изучалась зависимость между относительным вкладом в светорассеивание монохроматического лазерного излучения на наночастицах слюны и их диаметров.
Требования к забору слюны сводились к следующему: после ополаскивания водой ротовой полости слюна собиралась в пластиковую пробирку или «контейнер для забора биоматериала» натощак не ранее 4-х часов с момента последнего приёма пищи и/или медикаментов, к ней добавлялось 5 мл. физиологического раствора хлорида натрия (в таком виде РГС может храниться до исследования неограниченное время при температуре -20-30 градусов Цельсия в морозильной камере холодильника). Затем образец РГС помещался в центрифужную пробирку и проводилось центрифугирование при 2500 об/мин, после которого надосадочная жидкость помещалась в кювету лазерного спектроскопа для проведения самого исследования.
Проведенный на предварительном этапе работы анализ зависимости спектров слюны от возраста, пола, сезона и этнической принадлежности показал, что влияние вышеперечисленных факторов на спектроскопические характеристики ничтожно малы и ими можно пренебречь.
Результаты
Исследование было подразделено на несколько этапов, первым из которых являлось определение характерных особенностей спектра РГС практически здоровых людей. На Рис. 2 представлен наиболее типичный спектр РГС практически здоровых людей.
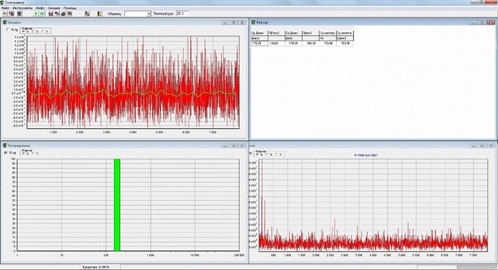
Рис. 2. Наиболее типичный спектр РГС практически здоровых людей.
Основными особенностями, характеризующими РГС-спектры практически здоровых людей, являлись мономодальность распределения частиц слюны по размеру: максимальный вклад (100%) в светорассеяние на наночастицах среднего гидродинамического диаметра 178 нм и отсутствие наночастиц в спектральных поддиапазонах 0-178 нм и 179-5000 нм, что позволяет использовать данные усреднённые значения в качестве референтных показателей при дальнейших расчетах.
Второй этап исследований проводился с целью определения сдвигов в субфракциях наночастиц пациентов с наиболее распространёнными функциональными изменениями сердечно-сосудистой системы. На Рис. 3 представлен наиболее типичный спектр РГС пациентов с общесоматическими заболеваниями печени не аутоиммунной природы.
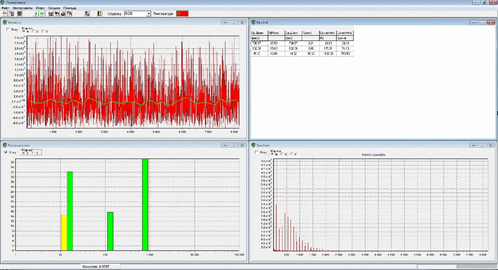
Рис. 3. Наиболее типичный спектр РГС пациентов с общесоматическими заболеваниями печени не аутоиммунной природы.
РГС-спектры лиц с общесоматическими заболеваниями печени не аутоиммунной природы характеризовались трёхмодальным распределением частиц слюны по размеру с превалирующим вкладом в светорассеяние (СР) на наночастицах мелкого размера 15 нм при 47%-ном вкладе в СР. Доля вклада в СР крупных частиц диаметром 791 нм составляла 38%. Наночастицы среднего спектрального поддиапазона диаметром 132 нм обусловливали 15%-ный вклад в рассеяние света.
На Рис. 4 показан наиболее типичный спектр слюны больных с АИГ.
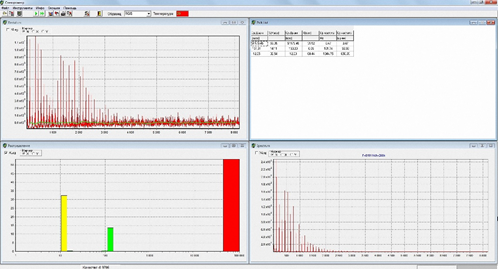
Рис. 4. Наиболее типичный спектр РГС больных с АИГ.
Наиболее типичная гистограмма распределения наночастиц по размеру и вкладу в светорассеяние у больных с АИГ характеризовалась трёхмодальностью и преимущественностью рассеяния света на частицах сверхкрупного диаметра 51174 нм при вкладе в светорассеяние 53%, вклад наночастиц среднего диаметра 131 нм составлял 14%, мелких частиц 12 нм - 33%.
Из графической информации, представленной на рисунках 2-4, следует, что в отличие от спектров РГС практически здоровых людей и пациентов с общесоматическими заболеваниями печени (ОЗП) не аутоиммунной природы спектральные характеристики РГС пациентов с АИГ характеризуются статистически достоверно (р<0,001) высоким вкладом в рассеяние света на частицах сверхкрупного диаметра.
Таблица 2.
Степени дифференцированности спектров РГС практически здоровых лиц, пациентов с ОЗП и АИГ, %
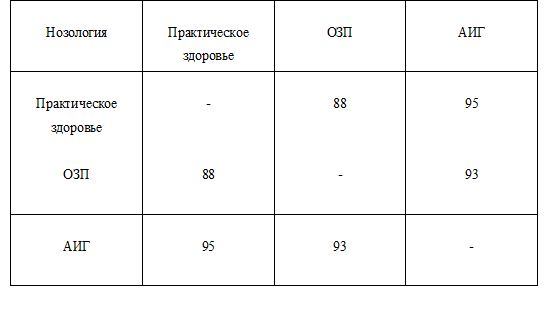
Как показано в Таб. 2, спектры РГС больных с АИГ статистически достоверно (р<0,001) дифференцируются от РГС-спектров пациентов с ОЗП и практически здоровых людей.
Ранее проведённая оценка диагностической информативности метода МАН использовалась для расчета у здоровых лиц - для установления показателя диагностической специфичности, у больных - для установления показателя диагностической чувствительности; во всех группах обследуемых - для расчета показателя диагностической эффективности теста.
Диагностическая чувствительность (1) представляла собой процентное выражение частоты истинно положительных результатов исследования субфракционного состава слюны у больных с АИГ:
Диагностическая чувствительность = (ИП/(ИП+ЛО))х100% (1)
где ИП - истинно положительные результаты, ЛО - ложноотрицательные результаты.
Диагностическая специфичность (2) теста оценивалась как процентное выражение частоты истинно отрицательных результатов у здоровых лиц:
Диагностическая специфичность = (ИО/(ИО+ЛП))х100% (2)
где ЛП - ложноположительные результаты, ИО - истинно отрицательные результаты.
Диагностическая эффективность (3) метода определялась процентным отношением истинных, т.е. соответствующих состоянию обследуемых пациентов результатов теста к общему числу полученных результатов:
Диагностическая эффективность = ((ИО+ИП)/(ИП+ИО+ЛП+ЛО))х100% (3)
Показатель предсказательной ценности положительного результата (4) рассчитывался по формуле:
Предсказательная ценность положительного результата = (ИП/(ИП+ЛП))х100% (4)
и применялся для оценки вероятности наличия заболевания у обследуемого с положительным результатом теста.
Показатель предсказательной ценности отрицательного результата (5) рассчитывался по формуле:
Предсказательная ценность отрицательного результата = (ИО/(ИО+ЛО))х100% (5)
и применялся для оценки вероятности отсутствия заболевания у обследуемого с отрицательным результатом тестирования.
Показатель диагностической специфичности метода МАН, вычисленный по группе практически здоровых лиц, составил 93%, диагностическая чувствительность метода в отношении АИГ составила 95%, показатель диагностической эффективности составлял 94%.
В наше исследование было включено лишь 14 пациентов с АИГ и поэтому представленные результаты могут иметь ориентировочный характер. Для более точной оценки чувствительности теста требуется исследование слюны большего числа пациентов. Тем не менее представленные результаты научного исследования демонстрируют перспективность дальнейшей работы в этом направлении по оптимизации метода МАН для задач по неинвазивной диагностике АИГ. В частности, планируется работа по доработке диагностического алгоритма, основанного на новейших разработках в области искусственного интеллекта. Решение этих вопросов позволит внести усовершенствования в разработанный алгоритм скрининга и диагностики АИГ, способный успешно конкурировать с другими диагностическими тест-системами.
Общеизвестно, что на доклинической стадии и при латентном течении болезни пациенты с АИГ могут не предъявлять патогномоничных жалоб, и лишь при манифестации патологического процесса у больных может возникать характерная клиническая симптоматика, заставляющая его обратиться к врачу. Но, как свидетельствуют статистические данные, такое обращение является запоздалым в связи с уже имеющимися осложнениями и системными проявлениями заболевания, что не даёт возможности ни пациенту, ни врачу надеяться на радикальность лечения. Именно поэтому актуальным является применение МАН для неинвазивной диагностики АИГ, когда в связи со своевременно выставленным диагнозом лечебные мероприятия будут являться максимально эффективными.
Обсуждение
Таким образом, слюна, как и кровь, содержит множество наночастиц, включая молекулы белка (в т.ч. антител) и нуклеиновых кислот, что отражает патофизиологический статус пациента (его гомеостаз) на момент исследования; однако, в отличие от других биологических жидкостей, разработанный алгоритм диагностики АИГ по слюне предлагает простой, недорогой, безопасный и неинвазивный подход для выявления местных и органных патологических процессов, и обладает высоким потенциалом как один из элементов развития современных высокоточных методов лабораторной диагностики. МАН позволяет выявить и оценить изменения в системе гомеостаза неинвазивным способом – по слюне, обеспечивая при этом высокую точность и экспрессность исследований. Исследования выполняются с минимальным объемом РГС, подготовка которого обеспечивает сохранение уникальной нативной структуры ее частиц, с быстрой регистрацией математически обработанных результатов.
Как было показано, в ходе проведения многоэтапных спектрометрических исследований РГС у больных АИГ в образцах слюны обнаруживались крупные агломераты частиц диаметром свыше 1000 нм в сочетании с высоким количеством мелких и средних наночастиц, что наиболее вероятно связано с имеющими место в организме больных процессами аутоантителообразования с формированием циркулирующих иммунных комплексов (ЦИК) и сопутствующей диспротеинемии. В более чем в 90% случаев исследований программой-классификатором МАН у больных с АИГ регистрировались патофизиологические нарушения, а именно: аутоиммунного, воспалительного и дегенеративно-дистрофического характера, что, наиболее вероятно, было обусловлено сочетанной вовлечённостью органов и систем в патологический процесс.
Выводы
Таким образом, значение слюны как биоматериала для трудно переоценить, что делает необходимым рассматривать МАН в качестве альтернативного существующим методам диагностики АИГ. Как было показано, метод МАН позволяет статистически достоверно дифференцировать АИГ и ОЗП.
Учитывая увеличение числа людей, страдающих АИГ и сопряжёнными осложнениями, во всём мире возрастает обеспокоенность её настоящими и долгосрочными последствиями, что послужило поводом к изучению актуальной проблемы современного человечества – борьбе с возрастающей заболеваемостью АИГ и разработке более совершенных и объективных методов её неинвазивной диагностики. В представленной работе представлена информация об аппаратно-диагностическом комплексе МАН, разработанном для проведения количественного анализа молекулярного состава биологических жидкостей, и алгоритме диагностики АИГ по ротоглоточным смывам.
Отличительными особенностями разработанной схемы являются: оригинальная система регистрации данных на фотоприёмнике с использованием детекции рассеянного света через систему призменных поляризаторов и фотоэлектронного умножителя, а также аналого-цифровой платы для оцифровки данных. Обработка данных, а именно вычисление автокорреляционной функции и дальнейший её анализ, производится на компьютере, что позволяет сделать схему МАН мобильной и доступной. Разработанная программа обработки данных (классификатор), вместе с подобранными параметрами схемы регистрации сигналов рассеяния позволяет добиться точности определения размеров наночастиц в полидисперсных растворах до 0.1-0,5 нм. Модельные эксперименты, проведенные на латексных наносферах, подтвердили точность разработанного прибора. По сравнению с прочими методами медицинских и биологических исследований, аппаратно-диагностический комплекс МАН обладает рядом неоспоримых преимуществ, а именно: имеет широкий диапазон исследуемых фракций, позволяет проводить одновременный анализ субфракций размером от мономерных наночастиц до высокополимерных иммунных комплексов, требует минимальное количество исследуемого материала, забор которого прост и неинвазивен, а также не требует сложных процедур подготовки образцов к исследованию, обладает высокой скоростью измерений, достаточными показателями чувствительности и специфичности для проведения широкомасштабного скрининга населения для диагностики аутоиммунных повреждений печени.
В работе был описан алгоритм исследования нативной биологической жидкости (слюна), представлены принципиальная схема и принцип работы монохромного анализатора наночастиц, разработаны правила забора биоматериала и подготовки образцов слюны к исследованию, дано подробное описание процесса формирования групп пациентов и этапов исследования, описан алгоритм проведения диагностики АИГ. Спектральные характеристики больных с АИГ статистически достоверно (р<0,001) дифференцируются от спектров слюны практически здоровых лиц и пациентов с ОЗП высокими показателями вклада в светорассеяние на частицах сверхкрупного, мелкого и среднего гидродинамического диаметра.
Неоспоримыми преимуществами МАН для целей неинвазивной диагностики АИГ являются:
- объективность получаемых результатов тестирования;
- возможность достоверного определения АИГ по слюне;
- неинвазивность забора биоматериала, что практически исключает вероятность заражения медперсонала заболеваниями, передающимися через кровь;
- быстрое получение результатов тестирования;
- низкая стоимость.
Внедрение МАН-диагностики в практическое здравоохранение позволит врачам проводить объективную неинвазивную диагностику пациентов с подозрением на АИГ и оперативно определяться с методами лечения для предупреждения её осложнений, а также контролировать эффективность лечения и динамику его результатов.
Материалы данного научного исследования по практическому применению его результатов могут быть впоследствии рекомендованы медицинским организациям практического здравоохранения для включения данного метода в программу диспансеризации населения.
- Lewin, M., Vilgrain, V., Ozenne, V., Lemoine, M., Wendum, D., Paradis, V., Ziol, M., Arrivé, L., Beaugrand, M., Poupon, R., Valla, D., Chazouillères, O., & Corpechot, C. (2009). Prevalence of sclerosing cholangitis in adults with autoimmune hepatitis: a prospective magnetic resonance imaging and histological study. Hepatology (Baltimore, Md.), 50(2), 528–537. https://doi.org/10.1002/hep.23024 Moradpour, D., Penin, F., & Rice, C. M. (2007). Replication of hepatitis C virus. Nature reviews. Microbiology, 5(6), 453–463. https://doi.org/10.1038/nrmicro1645
- Mackay, I. R., Weiden, S., & Hasker, J. (1965). Autoimmune hepatitis. Annals of the New York Academy of Sciences, 124(2), 767–780. https://doi.org/10.1111/j.1749-6632.1965.tb19000.x
- Strassburg, C. P., & Manns, M. P. (2006). Autoimmune hepatitis in the elderly: what is the difference?. Journal of hepatology, 45(4), 480–482. https://doi.org/10.1016/j.jhep.2006.07.008
- Feld, J. J., Dinh, H., Arenovich, T., Marcus, V. A., Wanless, I. R., & Heathcote, E. J. (2005). Autoimmune hepatitis: effect of symptoms and cirrhosis on natural history and outcome. Hepatology (Baltimore, Md.), 42(1), 53–62. https://doi.org/10.1002/hep.20732
- Manns, M., Gerken, G., Kyriatsoulis, A., Staritz, M., & Meyer zum Büschenfelde, K. H. (1987). Characterisation of a new subgroup of autoimmune chronic active hepatitis by autoantibodies against a soluble liver antigen. Lancet (London, England), 1(8528), 292–294. https://doi.org/10.1016/s0140-6736(87)92024-1
- Boberg, K. M., Chapman, R. W., Hirschfield, G. M., Lohse, A. W., Manns, M. P., Schrumpf, E., & International Autoimmune Hepatitis Group (2011). Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. Journal of hepatology, 54(2), 374–385. https://doi.org/10.1016/j.jhep.2010.09.002
- Umemura, T., Zen, Y., Hamano, H., Joshita, S., Ichijo, T., Yoshizawa, K., Kiyosawa, K., Ota, M., Kawa, S., Nakanuma, Y., & Tanaka, E. (2011). Clinical significance of immunoglobulin G4-associated autoimmune hepatitis. Journal of gastroenterology, 46 Suppl 1, 48–55. https://doi.org/10.1007/s00535-010-0323-4
- Vergani, D., Alvarez, F., Bianchi, F. B., Cançado, E. L., Mackay, I. R., Manns, M. P., Nishioka, M., Penner, E., & International Autoimmune Hepatitis Group (2004). Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. Journal of hepatology, 41(4), 677–683. https://doi.org/10.1016/j.jhep.2004.08.002
- Muratori, L., Cataleta, M., Muratori, P., Lenzi, M., & Bianchi, F. B. (1998). Liver/kidney microsomal antibody type 1 and liver cytosol antibody type 1 concentrations in type 2 autoimmune hepatitis. Gut, 42(5), 721–726. https://doi.org/10.1136/gut.42.5.721
- Czaja, A. J., & Carpenter, H. A. (1993). Sensitivity, specificity, and predictability of biopsy interpretations in chronic hepatitis. Gastroenterology, 105(6), 1824–1832. https://doi.org/10.1016/0016-5085(93)91081-r
- European Association for the Study of the Liver (2015). EASL Clinical Practice Guidelines: Autoimmune hepatitis. Journal of hepatology, 63(4), 971–1004. https://doi.org/10.1016/j.jhep.2015.06.030
- Czaja A. J. (2016). Diagnosis and Management of Autoimmune Hepatitis: Current Status and Future Directions. Gut and liver, 10(2), 177–203. https://doi.org/10.5009/gnl15352
- Manns, M. P., & Meyer zum Büschenfelde, K. H. (1990). Nature of autoantigens and autoantibodies in autoimmune hepatitis. Springer seminars in immunopathology, 12(1), 57–65. https://doi.org/10.1007/BF00192682
- Czaja A. J. (1996). The variant forms of autoimmune hepatitis. Annals of internal medicine, 125(7), 588–598. https://doi.org/10.7326/0003-4819-125-7-199610010-00009
- Johnson, P. J., & McFarlane, I. G. (1993). Meeting report: International Autoimmune Hepatitis Group. Hepatology (Baltimore, Md.), 18(4), 998–1005. https://doi.org/10.1002/hep.1840180435
- Mackay I. R. (2008). Historical reflections on autoimmune hepatitis. World journal of gastroenterology, 14(21), 3292–3300. https://doi.org/10.3748/wjg.14.3292
- Vento, S., Garofano, T., Di Perri, G., Dolci, L., Concia, E., & Bassetti, D. (1991). Identification of hepatitis A virus as a trigger for autoimmune chronic hepatitis type 1 in susceptible individuals. Lancet (London, England), 337(8751), 1183–1187. https://doi.org/10.1016/0140-6736(91)92858-y
- Czaja A. J. (1984). Natural history, clinical features, and treatment of autoimmune hepatitis. Seminars in liver disease, 4(1), 1–12. https://doi.org/10.1055/s-2008-1040641
- Czaja A. J. (1993). Chronic active hepatitis: the challenge for a new nomenclature. Annals of internal medicine, 119(6), 510–517. https://doi.org/10.7326/0003-4819-119-6-199309150-00011
- Hennes, E. M., Zeniya, M., Czaja, A. J., Parés, A., Dalekos, G. N., Krawitt, E. L., Bittencourt, P. L., Porta, G., Boberg, K. M., Hofer, H., Bianchi, F. B., Shibata, M., Schramm, C., Eisenmann de Torres, B., Galle, P. R., McFarlane, I., Dienes, H. P., Lohse, A. W., & International Autoimmune Hepatitis Group (2008). Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology (Baltimore, Md.), 48(1), 169–176. https://doi.org/10.1002/hep.22322
- Mackay I. R. Autoimmune hepatitis: what must be said. Experimental and molecular pathology. 2012;93(3), 350–353. https://doi.org/10.1016/j.yexmp.2012.11.001
- Björnsson, E., Talwalkar, J., Treeprasertsuk, S., Neuhauser, M., & Lindor, K. (2011). Patients with typical laboratory features of autoimmune hepatitis rarely need a liver biopsy for diagnosis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 9(1), 57–63. https://doi.org/10.1016/j.cgh.2010.07.016
- European Association for the Study of the Liver (2015). EASL Clinical Practice Guidelines: Autoimmune hepatitis. Journal of hepatology, 63(4), 971–1004. https://doi.org/10.1016/j.jhep.2015.06.030
- Tanaka A. Acute presentation of autoimmune hepatitis: How to find and manage still remains unsolved. Hepatology research: the official journal of the Japan Society of Hepatology. 2013;43(6), 577–579. https://doi.org/10.1111/hepr.12031
- Manns M. P., Czaja A. J., Gorham J. D., Krawitt E. L., Mieli-Vergani G., Vergani D., Vierling J. M., American Association for the Study of Liver Diseases. Diagnosis and management of autoimmune hepatitis. Hepatology (Baltimore, Md.). 2010;51(6), 2193–2213. https://doi.org/10.1002/hep.23584
- Hennes E. M., Zeniya M., Czaja A. J., Parés A., Dalekos G. N., Krawitt E. L., Bittencourt P. L., Porta G., Boberg K. M., Hofer H., Bianchi F. B., Shibata M., Schramm C., Eisenmann de Torres B., Galle P. R., McFarlane I., Dienes H. P., Lohse A. W., & International Autoimmune Hepatitis Group. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology (Baltimore, Md.). 2008;48(1), 169–176. https://doi.org/10.1002/hep.22322
- van Gerven N. M., de Boer Y. S., Mulder C. J., van Nieuwkerk C. M., Bouma G. Auto immune hepatitis. World journal of gastroenterology. 2016;22(19), 4651–4661. https://doi.org/10.3748/wjg.v22.i19.4651
- Gulari E., Chu B., Gulari E., Tsunashima Y. Photon correlation spectroscopy of particle distributions. Journal of Chemical Physics. 1979;70:3965-3972. https://doi.org/10.1063/1.437950
- Величко Е.Н., Непомнящая Э.К., Соколов А.В., Кудряшова Т.Ю. Лазерный корреляционный спектрометр для оценки размеров и динамики изменения размеров структур в биологических жидкостях. Оптика и спектроскопия. 2020;129(7):950. [Velichko E.N., Nepomnyashchaya E.K., Sokolov A.V., Kudryashova T.Yu. Laser Correlation Spectrometer for Assessing the Size and Dynamics of Changes in the Size of Structures in Biological Fluids]. Optics and Spectroscopy. 2020;128:959–963. https://doi.org/10.21883/OS.2020.07.49567.63-20
- Stetefeld J., McKenna S.A., Patel T.R. Dynamic light scattering: a practical guide and applications in biomedical sciences. Biophysical Reviews. 2016;8:409-427. https://doi.org/10.1007/s12551-016-0218-6
- Lebedev A.D., Ivanova M.A., Lomakin A.V., Noskin V.A. Heterodyne quasi-elastic light-scattering instrument for biomedical diagnostics. Appl Opt. 1997;36(30):7518-https://doi.org/10.1364/ao.36.007518
- Ломакин А.В. Изучение внутренней динамики макромолекул методом лазерной корреляционной спектроскопии. УФН 1987;153:360–362. [Lomakin A.V. Study of the internal dynamics of macromolecules by the method of laser correlation spectroscopy Sov. Phys. Usp. 1987;30:914–916]. https://doi.org/10.3367/UFNr.0153.198710j.0360
- Kotov O.I., Liokumovich L.B., Markov S.I., Medvedev A.V., Nikolaev V.M. Remote interferometer with polarizing beam splitting. Tech. Phys. Lett. 2000;26:415–417. https://doi.org/10.1134/1.1262863
- Максимова Е.А., Бурейко С.Ф., Левин С.Б., Державец Л.М. Метод двумерной корреляционной спектроскопии для улучшения аппроксимации одномерных спектров. Химическая физика. 2015;34(8):55-57. [Maksimova E.A., Bureiko S.F., Levin S.B., Derzhavets L.M. Russian Journal of Physical Chemistry. 2015;9:558-560]. https://doi.org/10.7868/S0207401X15080130
- Liokumovich L.B., Kostromitin A.O., Ushakov N.A., Kudryashov A.V. Method for Measuring Laser Frequency Noise. J Appl Spectrosc. 2020;86:1106–1112. https://doi.org/10.1007/s10812-020-00947-x
- Mogridge J. Using light scattering to determine the stoichiometry of protein complexes. Methods Mol Biol. 2004;261:113-8. https://doi.org/10.1385/1-59259-762-9:113
- Gast K., Fiedler C. Dynamic and static light scattering of intrinsically disordered proteins. Methods Mol Biol. 2012;896:137-61. https://doi.org/10.1007/978-1-4614-3704-8_9
- Николаев А. И., Антонова И. Н., Донская О. С., Владимирова Л. Г. Алгоритм анализа ЛК-спектров для неинвазивной диагностики заболеваний по образцам ротоглоточного смыва. Медицинский алфавит. 2019;4(35):23-27. [Nikolaev A.I., Antonova I.N., Donskaya O.S., Vladimirova L.G. LC‑spectra analysis algorithm for non‑invasive diagnostics by oropharyngeal washout samples]. Medical alphabet. 2019;4(35):23-27. https://doi.org/10.33667/2078-5631-2019-4-35(410)-23-27
- Малек А.В., Самсонов Р.В., Кьези А. Перспективы разработки методов диагностики и мониторинга онкологических заболеваний на основе анализа экзосом, секретируемых опухолевыми клетками. Российский биотерапевтический журнал. 2015;14(4):9-18. [Malek A.V., Samsonov R.B., Chiesi A. Development of cancer diagnostics and monitoring methods based on analysis of tumor-derived exosomes. Russian Journal of Biotherapy. 2015;14(4):9-18. (In Russ.)]. https://doi.org/10.17650/1726-9784-2015-14-4-9-18
- Südhof T. The molecular machinery of neurotransmitter release (Nobel lecture). Angew Chem Int Ed Engl. 2014;53(47):126-717. https://doi.org/10.1002/anie.201406359
- Liokumovich L., Muravyov K., Skliarov P., Ushakov N. Signal detection algorithms for interferometric sensors with harmonic phase modulation: miscalibration of modulation parameters. Applied Optics. 2018;57:7127-7134. https://doi.org/10.1364/AO.57.007127
- Stetefeld J., McKenna S.A., Patel T.R. Dynamic light scattering: a practical guide and applications in biomedical sciences. Biophys. Rev. 2016;8:409–427. https://doi.org/10.1007/s12551-016-0218-6
- Носкин В. А. Лазерная корреляционная спектроскопия квазиупругого рассеяния. УФН 1987;(153):358–360. [Noskin V. A. Laser correlation spectroscopy of quasielastic scattering. Sov. Phys. Usp. 1987;(30):913–914]. https://doi.org/10.1070/PU1987v030n10ABEH002972
- Chayen N., Dieckmann M., Dierks K., Fromme P. Ann N.Y. Size and shape determination of proteins in solution by a noninvasive depolarized dynamic light scattering instrument. Acad Sci. 2004;1027:20-7. https://doi.org/10.1196/annals.1324.003
- Nepomniashchaia E.K., Velichko E.N., Aksenov E.T. Inverse problem of laser correlation spectroscopy for analysis of polydisperse solutions of nanoparticles. Journal of Physics: Conference Series, Volume 769 012025. https://doi.org/10.1088/1742-6596/769/1/012025
- Xu R. Light scattering: A review of particle characterization applications. Particuology. 2015;18:11-21. https://doi.org/10.1016/j.partic.2014.05.002